教招笔试中考察反应热计算的解题思路
http://hebei.hteacher.net 2023-03-02 14:18 河北教师招聘 [您的教师考试网]
在教师招聘考试中,时常考察到关于反应热的计算,出题时往往会给几个已知反应热的热化学方程式,然后求算某个目标方程式的反应热。此时,考生就需要利用盖斯定律,将已知的若干方程式组合得出目标方程式,从而依据变换关系求算反应热。这个应用的过程本身不难,但考试时间分秒必争,若能利用一些做题技巧,则可以大大加快做题速度,并能避免不必要的计算错误,故这里就给大家分享下快速解题的思路。
【例1】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
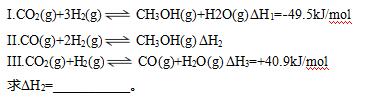
【答案】-90.4kJ/mol。
解题思路:利用盖斯定律,从已知方程中组合出目标方程,求算反应热。
解析:方程II可以认为是方程I减去方程III,故其反应热ΔH2=ΔH1-ΔH3=-49.5kJ/mol-40.9kJ/mol=-90.4kJ/mol。
【点评】本题是利用盖斯定律求算反应热的基本题型,本题分析过程较为简单,考试在计算中需要明确目标方程式是如何从已知方程式中转变而来的。特别的,反应热的正负值要带入计算,如果计算结果为正值,也要标记上“+”号,另外也不要忘记反应热的单位,保证答案的严谨性。
【例2】NH3、NO、NO2都是有毒气体,必须经过严格处理,否则会污染空气。
(1)已知如下热化学方程式:
①N2(g)+O2(g)=2NO(g) ΔH1=akJ/mol;
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=bkJ/mol
③2NO(g)+O2(g)=2NO2(g) ΔH3=ckJ/mol;
则4NH3(g)+7O2(g)=4NO2(g)+6H2O(g) ΔH=___________。
【答案】(2a+b+2c)kJ/mol。
解析:本题的目标方程可以由2个①+1个②+2个③得到,故ΔH=(2a+b+2c)kJ/mol。
【点评】本题依然是关于盖斯定律的典型计算,但涉及到3个方程式的组合变换。可以通过抓住关键物质从而以最快速度解题:
首先,观察目标方程式:4NH3(g)+7O2(g)=4NO2(g)+6H2O(g),明确各物质。
其次,观察已知方程式,关注在各个已知方程式中仅出现一次物质(关键物质):
如②4NH3(g)+3O2(g)=2N2(g)+6H2O(g),NH3和H2O是目标方程中的物质,且仅在②中出现;
③2NO(g)+O2(g)=2NO2(g),NO2为目标方程中的物质,且仅在③中出现;
观察这些关键物质在目标方程和已知方程中的系数可知,为组合得到目标方程,必然需要1个②+2个③。此时1个②的加入会在等号右侧产生2N2(g),而N2仅在①中出现,且在等号左侧,故必然需要+2个①。
由此分析可快速推断出目标方程来源于2个①+1个②+2个③的组合,故得到对应的反应热为ΔH=(2a+b+2c)kJ/mol。由于此法的结果是通过这些已知方程式中仅出现一次物质(关键物质)分析得到的,故其它无关物质(如本题中的O2与NO等)会自然抵消而满足目标方程的系数,答案准确且无需核验,从而大大提高解题速度,并能避免在草稿中对多个方程组合变化时由于粗心大意加和混乱得不到结果的情况。
此类抓“关键物质”的方法思路,应用熟练后,能帮助考生在考试紧张的氛围中以最快速度理清盖斯定律相关问题的解题思路,很大程度上缩短解题时间。这个方法的核心在于观察并抓住那些仅在某一个已知方程中出现,而不再其他方程中出现的物质,牢记这点,就能很快组合出目标方程。
当然,值得一提的还有答案的严谨性,ΔH是有单位的,且需要标明正负。如果最终答案是代数组合,如ΔH=(2a+b+2c)kJ/mol,由于代数a/b/c的正负未知,则省略标注“+”号。
推荐阅读:
责任编辑:云云
- · 河北教师教育网
- · 石家庄教师教育网
- · 唐山教师教育网
- · 秦皇岛教师教育网
- · 邯郸教师教育网
- · 邢台教师教育网
- · 保定教师教育网
- · 张家口教师教育网
- · 承德教师教育网
- · 沧州教师教育网
- · 廊坊教师教育网
- · 衡水教师教育网
- · 石家庄长安区教师教育网
- · 石家庄桥西区教师教育网
- · 石家庄新华区教师教育网
- · 井陉教师教育网
- · 裕华教师教育网
- · 藁城教师教育网
- · 鹿泉教师教育网
- · 栾城教师教育网
- · 正定教师教育网
- · 行唐教师教育网
- · 灵寿教师教育网
- · 高邑教师教育网
- · 深泽教师教育网
- · 赞皇教师教育网
- · 无极教师教育网
- · 石家庄平山教师教育网
- · 元氏教师教育网
- · 赵县教师教育网
- · 辛集教师教育网
- · 晋州教师教育网
- · 河北教育信息网
- · 石家庄教育信息网
- · 唐山教育信息网
- · 秦皇岛教育信息网
- · 邯郸教育信息网
- · 邢台教育信息网
- · 保定教育信息网
- · 张家口教育信息网
- · 承德教育信息网
- · 沧州教育信息网
- · 廊坊教育信息网
- · 衡水教育信息网
- · 石家庄长安区教育信息网
- · 石家庄桥西区教育信息网
- · 石家庄新华区教育信息网
- · 井陉教育信息网
- · 裕华教育信息网
- · 藁城教育信息网
- · 鹿泉教育信息网
- · 栾城教育信息网
- · 正定教育信息网
- · 行唐教育信息网
- · 灵寿教育信息网
- · 高邑教育信息网
- · 深泽教育信息网
- · 赞皇教育信息网
- · 无极教育信息网
- · 石家庄平山教育信息网
- · 元氏教育信息网
- · 赵县教育信息网
- · 辛集教育信息网
- · 晋州教育信息网
- · 河北人事考试信息网
- · 石家庄人事考试信息网
- · 唐山人事考试信息网
- · 秦皇岛人事考试信息网
- · 邯郸人事考试信息网
- · 邢台人事考试信息网
- · 保定人事考试信息网
- · 张家口人事考试信息网
- · 承德人事考试信息网
- · 沧州人事考试信息网
- · 廊坊人事考试信息网
- · 衡水人事考试信息网
- · 长安区人事考试信息网
- · 桥西区人事考试信息网
- · 新华区人事考试信息网
- · 井陉人事考试信息网
- · 裕华区人事考试信息网
- · 藁城区人事考试信息网
- · 鹿泉区人事考试信息网
- · 栾城区人事考试信息网
- · 正定人事考试信息网
- · 行唐人事考试信息网
- · 灵寿人事考试信息网
- · 高邑人事考试信息网
- · 深泽人事考试信息网
- · 赞皇人事考试信息网
- · 无极人事考试信息网
- · 平山人事考试信息网
- · 元氏人事考试信息网
- · 赵县人事考试信息网
- · 辛集人事考试信息网
- · 晋州人事考试信息网
上一篇: 空间站“变出”奥运五环所含化学知识








