教师招聘面试高中化学《元素周期律》说课稿
https://jiaoshi.huatu.com 2023-12-18 10:44 教师招聘网 [您的教师考试网]
四、说教学过程
接下来我重点来谈一谈本节课的教学过程,我将从导入、新授、巩固、小结和作业5个环节来展开。
(一)复习导入
考虑到学生的知识基础,在这里我采用了温故知新的方式来导入本节新课:首先请学生回顾碱金属元素、卤族元素的原子结构和性质是怎样的?由此总结得出:元素周期表中同主族元素的性质有着相似性和递变性。从而引出新的问题:周期表中同周期元素的性质有什么变化规律?导入新课。
这一导入方式从原子结构出发,引导学生探究元素性质的变化规律,体现“结构决定性质”的观念,有助于构建元素“位”“构”“性”之间的内在联系。
(二)新知探究
1.初探元素周期律
教师引导:以教材101页,表4-5为依据,用坐标格子描点划线的形式得出的最外层电子数、原子半径、化合价随原子序数递增的变化规律。
学生活动:展示图示,并回答,得出电子层数、最外层电子数、原子半径、最高或最低化合价的变化随着原子序数递增出现周期性变化规律。
设计意图:让学生学习常用的数据处理方法和表示方式,培养学生分析、处理数据的能力和相互合作的意识,也让学生获得直观形象的感性知识,为归纳元素周期律奠定基础。
2.再探元素周期律
提问:元素的化学性质(金属性、非金属性)呈现出怎样的规律?
提示:
元素金属性强弱判断依据:①单质还原性强弱(与水或酸反应置换出氢气的难易程度);②最高价氧化物水化物的碱性强弱。
元素非金属性强弱判断依据:①单质与H2反应的难易和生成氢化物的稳定性;②最高价氧化物水化物的酸性。
学生活动:以11-17号元素为例探究元素的金属性和非金属性的变化规律。
(1)“实验探究”金属性变化规律
a.实验前预测11~17号元素的金属性和非金属性如何变化?
b.结合所提供的药品:镁条、铝片、稀盐酸、蒸馏水、MgCl2、AlCl3、NaOH、酚酞;仪器:小试管、砂纸设计实验验证对Na、Mg、Al三种金属金属性的判断。
c.实验后反思评价,交流,得出金属性、变化规律。
(2)“阅读探究”非金属性变化规律
a.阅读教材103页硅、硫、氯元素单质化合物的资料信息,以小组为单位,从信息资料中抽提出有用信息,对比出硅、磷、硫、氯的非金属性强弱。
b.将金属与非金属联合起来,总结出第三周期元素金属性、非金属性变化的结规律。
设计意图:通过“实验探究”、“阅读探究”、“归纳整理”,旨在培养学生自学能力以及获取并整合信息的能力。
3.元素周期律的本质
提问:为什么元素的金属性、非金属性会呈现一定的变化规律?对其他周期的主族元素进行同样的研究,是不是会得出类似的规律?
总结:元素的金属性、非金属性随着原子序数的递增而呈现周期性的变化。元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
设计意图:能从原子结构的角度认识元素性质的周期性变化,认识元素“位”“构”“性”之间的内在联系。
(三)拓展提升
在这一环节我设计了两个部分的内容:
1.介绍元素周期律的应用
教师引导:介绍农药、半导体材料、催化剂、特种合金材料等的选择,以及周期表周期律具体应用。
设计意图:通过视野的开拓和对一些知识的感性认识,加深对认识学习周期表周期律的意义。
2.习题:结合卤族元素的性质,预测砹元素的性质,包括单质的颜色、状态,砹化银的溶解性等。
设计意图:引导学生利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其化合物的性质。
(四)课堂小结
学生总结本节课的收获,教师进行点拨,评价学生本节课的表现。提升学生的总结能力,加深学生对本节课重点知识的回顾与掌握。
(五)作业布置
最后我会布置两个作业:①课后习题;②课下查阅资料,了解门捷列夫预言了哪些新元素,这些元素是如何被确认的,撰写研究报告,与学习小组的同学进行交流。
设计意图:巩固拓展本节课的学习内容,同时化学史的相关内容能够激发学生的学习兴趣,逐步形成严谨求实的科学态度。
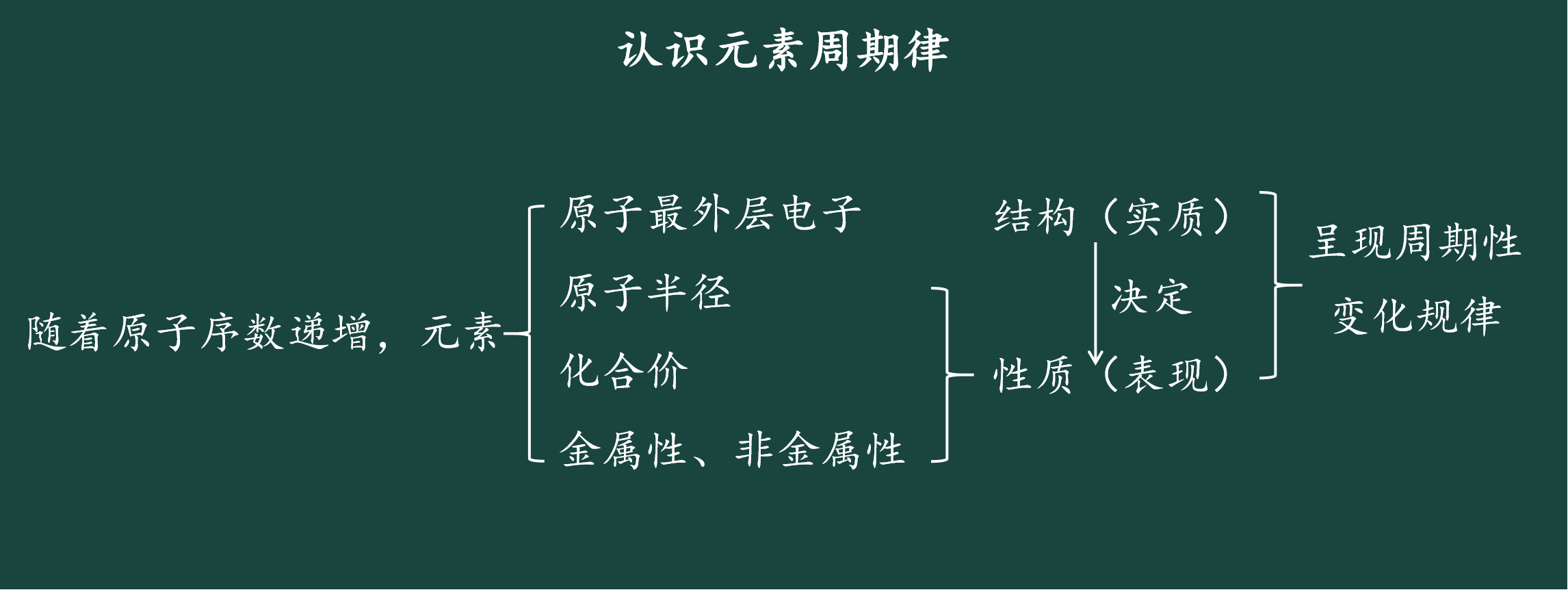
五、说板书设计
最后,我说一下我的板书设计,从板书中能够看出本节课的重点内容即为“元素周期律”,从中也能体现“原子结构决定元素性质”,体现了元素“位”“构”“性”之间的内在联系。
推荐阅读:
责任编辑:欣欣
- · 北京市教师教育网
- · 天津教师教育网
- · 河北教师教育网
- · 山西省教师教育网
- · 内蒙古教师教育网
- · 辽宁教师教育网
- · 吉林教师教育网
- · 黑龙江教师教育网
- · 上海教师教育网
- · 江苏教师教育网
- · 浙江教师教育网
- · 安徽教师教育网
- · 福建教师教育网
- · 江西教师教育网
- · 山东教师教育网
- · 河南教师教育网
- · 湖北教师教育网
- · 湖南教师教育网
- · 广东教师教育网
- · 深圳教师教育网
- · 广西教师教育网
- · 海南教师教育网
- · 重庆教师教育网
- · 四川教师教育网
- · 贵州教师教育网
- · 云南教师教育网
- · 西藏教师教育网
- · 陕西教师教育网
- · 甘肃教师教育网
- · 青海教师教育网
- · 宁夏教师教育网
- · 新疆教师教育网
- · 北京市教育信息网
- · 天津教育信息网
- · 河北教育信息网
- · 山西省教育信息网
- · 内蒙古教育信息网
- · 辽宁教育信息网
- · 吉林教育信息网
- · 黑龙江教育信息网
- · 上海教育信息网
- · 江苏教育信息网
- · 浙江教育信息网
- · 安徽教育信息网
- · 福建教育信息网
- · 江西教育信息网
- · 山东教育信息网
- · 河南教育信息网
- · 湖北教育信息网
- · 湖南教育信息网
- · 广东教育信息网
- · 深圳教育信息网
- · 广西教育信息网
- · 海南教育信息网
- · 重庆教育信息网
- · 四川教育信息网
- · 贵州教育信息网
- · 云南教育信息网
- · 西藏教育信息网
- · 陕西教育信息网
- · 甘肃教育信息网
- · 青海教育信息网
- · 宁夏教育信息网
- · 新疆教育信息网
- · 北京人事考试信息网
- · 天津人事考试信息网
- · 河北人事考试信息网
- · 山西省人事考试信息网
- · 内蒙古人事考试信息网
- · 辽宁人事考试信息网
- · 吉林人事考试信息网
- · 黑龙江人事考试信息网
- · 上海人事考试信息网
- · 江苏人事考试信息网
- · 浙江人事考试信息网
- · 安徽人事考试信息网
- · 福建人事考试信息网
- · 江西人事考试信息网
- · 山东人事考试信息网
- · 河南人事考试信息网
- · 湖北人事考试信息网
- · 湖南人事考试信息网
- · 广东人事考试信息网
- · 深圳人事考试信息网
- · 广西人事考试信息网
- · 海南人事考试信息网
- · 重庆人事考试信息网
- · 四川人事考试信息网
- · 贵州人事考试信息网
- · 云南人事考试信息网
- · 西藏人事考试信息网
- · 陕西人事考试信息网
- · 甘肃人事考试信息网
- · 青海人事考试信息网
- · 宁夏人事考试信息网
- · 新疆人事考试信息网
上一篇: 教师招聘面试高中化学《化学键》教案








